qaral
Himbersor
- Desde
- 21 Ago 2021
- Mensajes
- 2.433
- Reputación
- 1.388
Mañana... prepararos para ver como podremos regenerar miembros amastutados... sí ese también... lo otro, pues milagros a Lurdes... Qué década nos viene de prodigios: cómo conectar con el mal llamado más allá... viajar teletransportándonos, esperar que vendrán más...
TRES PARAPLÉJICOS VUELVEN A CAMINAR UN DÍA DESPUÉS DE RECIBIR UN IMPLANTE ELECTRÓNICO
La neuroestimulación eléctrica restaura los movimientos motores independientes a las pocas horas del inicio de la terapia en tres pacientes con parálisis sensoriomotora completa
Un sistema desarrollado por investigadores de la Ecole Polytechnique Fédérale de Lausana (EPFL) permite a los pacientes con una lesión completa de la médula espinal ponerse de pie, caminar e incluso realizar actividades recreativas como natación, ciclismo o montar en canoa.
Se trata de la estimulación eléctrica personalizada de la médula espinal mediante placas de electrodos diseñadas específicamente para lesiones de la médula espinal. En un estudio que se publica hoy 'Nature Medicine', esta innovadora técnica ha demostrado que restaura los movimientos motores independientes a las pocas horas del inicio de la terapia en tres pacientes con parálisis sensoriomotora completa.
Las lesiones de la médula espinal interrumpen la comunicación dentro del sistema nervioso, lo que lleva a la pérdida de funciones neurológicas esenciales y conducen a la parálisis.
La estimulación epidural eléctrica, es decir, la estimulación aplicada a la médula espinal había logrado restaurar la capacidad locomotora en modelos animales de lesión de la médula espinal, pero hasta ahora había sido menos efectiva en seres humanos por razones desconocidas.
En 2019 el equipo de Grégoire Courtine, de la Ecole Polytechnique Fédérale de Lausana (EPFL) en colaboración con el de Jocelyne Bloch, del Hospital Universitario de Lausanne, ambos en Suiza, aplicó esta terapia a tres pacientes que tenían diferentes tipos de lesión medular: lesión crónica de la médula espinal y parálisis parcial o completa de las extremidades inferiores. A la semana los tres podían caminar con muletas.
Esta fue la primera prueba de que su terapia, que utiliza la estimulación eléctrica para reactivar las neuronas espinales, podría funcionar eficazmente en los pacientes.
Ahora, el equipo dirigido por Courtine y Bloch ha mejorado su sistema con implantes más sofisticados controlados por un software de inteligencia artificial.
Los nuevos implantes, explicaron, pueden estimular la región de la médula espinal que activa los músculos del tronco y de las piernas.
Así, gracias a esta nueva tecnología, tres pacientes con parapléjicos no solo han vuelto a caminar, sino que hay dado un paso más. «Nuestros algoritmos para la estimulación imitan la naturaleza -explica Courtine-. Y nuestros cables maleables implantados han sido diseñados para colocarse debajo de las vértebras, directamente sobre la espina dorsal, lo que hace posible modular las neuronas que regulan grupos musculares específicos».
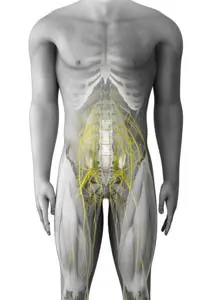
Electrodos - ©NeuroRestore-Jimmy_Ravier
Explica Courtine que «al controlar estos implantes, es posible activar la médula espinal como lo haría el cerebro de forma natural para que el paciente se levante, camine, nade o monte una bicicleta».
El italiano Michel Roccati fue uno de los tres afortunados en poder volver a caminar con sus propias el pasado diciembre. Michel había sufrido, cuatro años antes, un grave accidente de moto que le dejó parapléjico en silla de ruedas.
Días después de haber sido sometido al procedimiento quirúrgico en el que la cirujana Bloch implantó el nuevo cable en su médula espinal, Michel, junto a expertos del centro de investigación de Courtine y Bloch salió a las calles de Lausana a probar su nueva vida.
El andador de Michel tenía dos pequeños controles remotos que se conectaron de forma inalámbrica a una tableta que envía las señales a un marcapasos situado en el abdomen de Michel. El marcapasos, a su vez, transmite las señales al cable situado en la columna vertebral y estimula las neuronas específicas, lo que hace que Michel se mueva.

Paciente en bici - EPFL
Así, Michel cogió su el andador y se puso en marcha. El mismo presionaba el botón en el lado derecho del andador para dar un paso adelante con la pierna izquierda. Su pie izquierdo se elevó como por arte de magia y se posó en el suelo unos centímetros más adelante. Luego hizo lo mismo con el botón en su lado izquierdo, y su pie derecho se movió hacia adelante. ¡Estaba andando!
«Los primeros pasos fueron increíbles, ¡un sueño hecho realidad! -reconoce-. He pasado por un entrenamiento bastante intenso en los últimos meses, y me he fijado una serie de objetivos. Por ejemplo, ahora puedo subir y bajar las escaleras, y la próxima primavera espero poder caminar un kilómetro».
Otros dos pacientes también han probado con éxito el nuevo sistema. Y todo ello en apenas 24 horas.
«Los tres pacientes pudieron ponerse en pie, caminar, pedalear, nadar y controlar sus movimientos solo un día después de que se activaron sus implantes», destaca Courtine.
«Nuestro gran avance son los cables implantados, más largos y anchos, con electrodos dispuestos de una manera idéntica a las raíces de los nervios espinales -explica Bloch. Esto nos aporta un control preciso sobre las neuronas que regulan músculos específicos».
Además, este sofisticado sistema de cableado con electrodos permite una mayor selectividad y precisión en el control de las secuencias motoras para cada actividad: andar, montar en bicicleta, nadar...
«Gracias a los programas de estimulación específicos para cada tipo de actividad los pacientes pueden seleccionar la actividad deseada en la tableta y los protocolos correspondientes se transmiten al marcapasos en el abdomen», añade
Además, aunque resulta asombroso la rapidez con la que la terapia actúa, el beneficio va incrementándose con el paso del tiempo.
Escriben los investigadores que meses después los tres pacientes, que siguieron un régimen de entrenamiento basado en los programas de estimulación lo que les permitió recuperar masa muscular, podían moverse de manera más independiente y participar en actividades sociales como tomar una copa de pie en un bar.
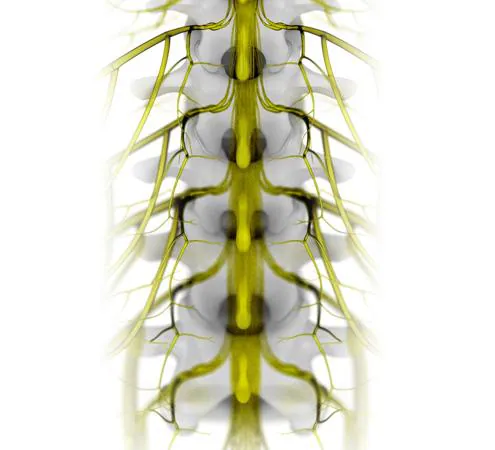
Electrodos - ©NeuroRestore-Jimmy_Ravier
Otro detalle es que todo el entrenamiento se puede hacer al aire libre, y no solo dentro de un laboratorio, gracias a que la tecnología está miniaturizada.
El siguiente paso, concluye Courtine, «convertir nuestros descubrimientos en tratamientos que puedan mejorar la vida de miles de personas en todo el mundo».
¿Y hasta dónde puede llegar esta técnica? Courtine cree que los avances tecnológicos van a ayudar mucho. «Las próximas generaciones de electrodos serán más precisas y más capaces de activar las áreas concisas».
En este sentido, están trabajando con la biotecnológica ONWARD Medical para desarrollar neurotecnología a medida con el objetivo de convertir este paradigma de rehabilitación en un tratamiento disponible en hospitales y clínicas de todo el mundo. «Estamos construyendo neurotecnología de próxima generación que también se probará lo más cercano al momento de la lesión, cuando el potencial de recuperación sea alto y el sistema neuromuscular todavía no haya sufrido la atrofia que sigue a la parálisis crónica. Nuestro objetivo es desarrollar un tratamiento de fácil acceso», añade Courtine.
Al igual que otras aproximaciones, esta tecnología no genera nuevas neuronas y no regenera nervios. En animales, señaló Courtine, «lo que hemos visto es que se reorganizan las conexiones neuronales en el córtex. El tratamiento logra esta nueva conexión cerebral, aunque en humanos es todavía una hipótesis».
¿Podrá la medicina regenerar un miembro amastutado en el futuro?
iguel Artime
25 de mayo de 2017
alamandra de fuego fotografiada en Walpersdorf, Alemania. (Crédito imagen: Wikipedia).
Es bien sabido que cuando a una salamandra se le corta una extremidad, esta vuelve a crecerle. Por desgracia los humanos no podemos realizar este mismo truco, algo que sin duda haría feliz a los millones de humanos que han sufrido una amastutación. Sin embargo nuestro organismo se las compone bastante bien para regenerar la piel perdida. Incluso nuestro estómago e hígado pueden crecer a partir de una fracción hasta volver a ocupar el volumen anterior. Bien, pero a pesar de que nuestro cuerpo puede realizar estos “trucos” menores, llegar a recuperar un brazo entero (con sus huesos, articulaciones, tendones, vasos sangúíneos, músculos, dermis, etc..) es algo totalmente fuera de nuestro alcance.
Sin embargo, algunos científicos creen que el cuerpo humano puede esconder el potencial que le equipare al de las salamandras, de quienes nos desviamos evolutivamente en el Devónico (nuestro antepasado común vivió hace 360 millones de años). Ese es el caso de David Gardiner, profesor de biología celular y del desarrollo en la Universidad de California Irvine, que acaba de colaborar con la web LiveScience en un interesante artículo sobre esta posibilidad.
Gardiner lleva décadas estudiando la regeneración en las salamandras, y ha llegado a aprender varias cosas sobre el mecanismo que permite a este anfibio recuperar indefinidamente un miembro amastutado. En su opinión, en el futuro nosotros también podremos ganar este “superpoder”, aunque no va a suceder de forma inmediata.
El optimismo viene de la presencia de células progenitora adultas en nuestro cuerpo. Estas células, inicialmente no diferenciadas, pueden transformarse en cualquier clase de tejido: óseo, muscular, nervioso, vascular, etc. Sin embargo, más allá de su funcionalidad “poniendo parches” aquí y allá, no pueden hacer crecer de nuevo un brazo amastutado.
Sin embargo, en el útero materno, los humanos somos capaces de generar sistemas y organos completos. A partir de la información genética, un embrión humano se desarrolla hasta formar una persona en solo nueve meses. De modo que en cierto modo, en nuestros genes existe la información precisa para decirle a las células progenitora dónde deben ubicarse y en qué tejido deben especializarse.
Para regenerar un miembro, las células progenitora necesitan precisamente eso, saber dónde están. De ese modo podrán construir las estructuras necesarias en el orden correcto. Las salamandras posee cierto número de genes que en los humanos figuran “desconectados”. Gardiner cree que tal vez esos genes permitan la regeneración, o al menos ayuden a controlar el proceso. Sin embargo, algo en el pasado evolutivo de los humanos llevó a que esos genes dejasen de expresarse del mismo modo que lo hacen en las salamandras.
Ajolote albino mostrando sus branquias externas. (Crédito imagen: Wikipedia).
¿Qué provocó esa divergencia evolutiva? Nadie lo sabe a ciencia cierta, aunque en 2013 el trabajo de un científico australiano llamado James Godwin (Universidad Monash) hizo un hallazgo que podría dar una pista clave en la resolución del misterio. Godwin descubrió que unas células del sistema inmunitario llamadas macrófagos, evitan en las salamandras la formación de tejido cicatrizal. Los macrófagos existen en otros animales, incluidos los humanos, y su función es la de detener las infecciones y provocar la inflamación, que es la señal que se lanza al cuerpo para indicar que es necesario reparar algo. Cuando se eliminan los macrófagos en el cuerpo de una salamandra, esta es incapaz de regenerar un miembro amastutado. En lugar de eso la herida se cubre con una cicatriz, justo lo que nos sucede a nosotros.
Otro de los aspectos a tener en cuenta si deseamos que los humanos puedan regenerar sus miembros perdidos es la neotenia, que es la capacidad que tienen algunos animales de conservarse jóvenes. El ejemplo más conocido lo tiene una salamandra mexicana llamada ajolote, que es capaz de retener sus características larvarias (es decir esquivar la madurez sensual) a voluntad. Por eso, un ajolote puede mostrar agallas (como un renacuajo) a pesar de haber desarrollado totalmente sus extremidades. Los humanos también poseemos neotenia, lo cual explica que nuestras crías sean las que atraviesan una infancia más larga de entre todos los grandes primates. Eso hace así mismo que la capacidad para curarse sea mayor en los humanos jóvenes que en los mayores.
En este aspecto, investigadores de Harvard descubieron que un gen llamado Lin28a (activo en animales y humanos inmaduros) está detrás de la capacidad que los ratones jóvenes tienen de regenerar tejido. Este gen está relacionado con el sistema de control del metabolismo de los animales, cuando se estimula puede hacer que un animal genere más energía, como si fuera más joven.
Como decía al principio, aún falta bastante tiempo para que los humanos podamos hacer “magia regenerativa” al estilo salamandra, pero la propia natuzaleza nos ofrece ejemplos animales en los que poder buscar soluciones. Quien sabe si ahora mismo hay un estudiante enamorado de la biología evolutiva, que dentro de unas décadas logre juntar todas las piezas del puzzle y resolver el misterio. Confiemos en el ingenio humano y en el avance de la ciencia.
Por cierto que si os parece interesante este tema os recomiendo encarecidamente leer ECM, o de cómo los gorrinos nos ayudan a regenerarnos.
TRES PARAPLÉJICOS VUELVEN A CAMINAR UN DÍA DESPUÉS DE RECIBIR UN IMPLANTE ELECTRÓNICO
La neuroestimulación eléctrica restaura los movimientos motores independientes a las pocas horas del inicio de la terapia en tres pacientes con parálisis sensoriomotora completa
Un sistema desarrollado por investigadores de la Ecole Polytechnique Fédérale de Lausana (EPFL) permite a los pacientes con una lesión completa de la médula espinal ponerse de pie, caminar e incluso realizar actividades recreativas como natación, ciclismo o montar en canoa.
Se trata de la estimulación eléctrica personalizada de la médula espinal mediante placas de electrodos diseñadas específicamente para lesiones de la médula espinal. En un estudio que se publica hoy 'Nature Medicine', esta innovadora técnica ha demostrado que restaura los movimientos motores independientes a las pocas horas del inicio de la terapia en tres pacientes con parálisis sensoriomotora completa.
Las lesiones de la médula espinal interrumpen la comunicación dentro del sistema nervioso, lo que lleva a la pérdida de funciones neurológicas esenciales y conducen a la parálisis.
La estimulación epidural eléctrica, es decir, la estimulación aplicada a la médula espinal había logrado restaurar la capacidad locomotora en modelos animales de lesión de la médula espinal, pero hasta ahora había sido menos efectiva en seres humanos por razones desconocidas.
En 2019 el equipo de Grégoire Courtine, de la Ecole Polytechnique Fédérale de Lausana (EPFL) en colaboración con el de Jocelyne Bloch, del Hospital Universitario de Lausanne, ambos en Suiza, aplicó esta terapia a tres pacientes que tenían diferentes tipos de lesión medular: lesión crónica de la médula espinal y parálisis parcial o completa de las extremidades inferiores. A la semana los tres podían caminar con muletas.
Esta fue la primera prueba de que su terapia, que utiliza la estimulación eléctrica para reactivar las neuronas espinales, podría funcionar eficazmente en los pacientes.
Ahora, el equipo dirigido por Courtine y Bloch ha mejorado su sistema con implantes más sofisticados controlados por un software de inteligencia artificial.
Los nuevos implantes, explicaron, pueden estimular la región de la médula espinal que activa los músculos del tronco y de las piernas.
Así, gracias a esta nueva tecnología, tres pacientes con parapléjicos no solo han vuelto a caminar, sino que hay dado un paso más. «Nuestros algoritmos para la estimulación imitan la naturaleza -explica Courtine-. Y nuestros cables maleables implantados han sido diseñados para colocarse debajo de las vértebras, directamente sobre la espina dorsal, lo que hace posible modular las neuronas que regulan grupos musculares específicos».

Electrodos - ©NeuroRestore-Jimmy_Ravier
Explica Courtine que «al controlar estos implantes, es posible activar la médula espinal como lo haría el cerebro de forma natural para que el paciente se levante, camine, nade o monte una bicicleta».
El italiano Michel Roccati fue uno de los tres afortunados en poder volver a caminar con sus propias el pasado diciembre. Michel había sufrido, cuatro años antes, un grave accidente de moto que le dejó parapléjico en silla de ruedas.
Días después de haber sido sometido al procedimiento quirúrgico en el que la cirujana Bloch implantó el nuevo cable en su médula espinal, Michel, junto a expertos del centro de investigación de Courtine y Bloch salió a las calles de Lausana a probar su nueva vida.
El andador de Michel tenía dos pequeños controles remotos que se conectaron de forma inalámbrica a una tableta que envía las señales a un marcapasos situado en el abdomen de Michel. El marcapasos, a su vez, transmite las señales al cable situado en la columna vertebral y estimula las neuronas específicas, lo que hace que Michel se mueva.

Paciente en bici - EPFL
Así, Michel cogió su el andador y se puso en marcha. El mismo presionaba el botón en el lado derecho del andador para dar un paso adelante con la pierna izquierda. Su pie izquierdo se elevó como por arte de magia y se posó en el suelo unos centímetros más adelante. Luego hizo lo mismo con el botón en su lado izquierdo, y su pie derecho se movió hacia adelante. ¡Estaba andando!
«Los primeros pasos fueron increíbles, ¡un sueño hecho realidad! -reconoce-. He pasado por un entrenamiento bastante intenso en los últimos meses, y me he fijado una serie de objetivos. Por ejemplo, ahora puedo subir y bajar las escaleras, y la próxima primavera espero poder caminar un kilómetro».
Otros dos pacientes también han probado con éxito el nuevo sistema. Y todo ello en apenas 24 horas.
«Los tres pacientes pudieron ponerse en pie, caminar, pedalear, nadar y controlar sus movimientos solo un día después de que se activaron sus implantes», destaca Courtine.
«Nuestro gran avance son los cables implantados, más largos y anchos, con electrodos dispuestos de una manera idéntica a las raíces de los nervios espinales -explica Bloch. Esto nos aporta un control preciso sobre las neuronas que regulan músculos específicos».
Además, este sofisticado sistema de cableado con electrodos permite una mayor selectividad y precisión en el control de las secuencias motoras para cada actividad: andar, montar en bicicleta, nadar...
«Gracias a los programas de estimulación específicos para cada tipo de actividad los pacientes pueden seleccionar la actividad deseada en la tableta y los protocolos correspondientes se transmiten al marcapasos en el abdomen», añade
Además, aunque resulta asombroso la rapidez con la que la terapia actúa, el beneficio va incrementándose con el paso del tiempo.
Escriben los investigadores que meses después los tres pacientes, que siguieron un régimen de entrenamiento basado en los programas de estimulación lo que les permitió recuperar masa muscular, podían moverse de manera más independiente y participar en actividades sociales como tomar una copa de pie en un bar.

Electrodos - ©NeuroRestore-Jimmy_Ravier
Otro detalle es que todo el entrenamiento se puede hacer al aire libre, y no solo dentro de un laboratorio, gracias a que la tecnología está miniaturizada.
El siguiente paso, concluye Courtine, «convertir nuestros descubrimientos en tratamientos que puedan mejorar la vida de miles de personas en todo el mundo».
¿Y hasta dónde puede llegar esta técnica? Courtine cree que los avances tecnológicos van a ayudar mucho. «Las próximas generaciones de electrodos serán más precisas y más capaces de activar las áreas concisas».
En este sentido, están trabajando con la biotecnológica ONWARD Medical para desarrollar neurotecnología a medida con el objetivo de convertir este paradigma de rehabilitación en un tratamiento disponible en hospitales y clínicas de todo el mundo. «Estamos construyendo neurotecnología de próxima generación que también se probará lo más cercano al momento de la lesión, cuando el potencial de recuperación sea alto y el sistema neuromuscular todavía no haya sufrido la atrofia que sigue a la parálisis crónica. Nuestro objetivo es desarrollar un tratamiento de fácil acceso», añade Courtine.
Al igual que otras aproximaciones, esta tecnología no genera nuevas neuronas y no regenera nervios. En animales, señaló Courtine, «lo que hemos visto es que se reorganizan las conexiones neuronales en el córtex. El tratamiento logra esta nueva conexión cerebral, aunque en humanos es todavía una hipótesis».
¿Podrá la medicina regenerar un miembro amastutado en el futuro?
iguel Artime
25 de mayo de 2017
alamandra de fuego fotografiada en Walpersdorf, Alemania. (Crédito imagen: Wikipedia).
Es bien sabido que cuando a una salamandra se le corta una extremidad, esta vuelve a crecerle. Por desgracia los humanos no podemos realizar este mismo truco, algo que sin duda haría feliz a los millones de humanos que han sufrido una amastutación. Sin embargo nuestro organismo se las compone bastante bien para regenerar la piel perdida. Incluso nuestro estómago e hígado pueden crecer a partir de una fracción hasta volver a ocupar el volumen anterior. Bien, pero a pesar de que nuestro cuerpo puede realizar estos “trucos” menores, llegar a recuperar un brazo entero (con sus huesos, articulaciones, tendones, vasos sangúíneos, músculos, dermis, etc..) es algo totalmente fuera de nuestro alcance.
Sin embargo, algunos científicos creen que el cuerpo humano puede esconder el potencial que le equipare al de las salamandras, de quienes nos desviamos evolutivamente en el Devónico (nuestro antepasado común vivió hace 360 millones de años). Ese es el caso de David Gardiner, profesor de biología celular y del desarrollo en la Universidad de California Irvine, que acaba de colaborar con la web LiveScience en un interesante artículo sobre esta posibilidad.
Gardiner lleva décadas estudiando la regeneración en las salamandras, y ha llegado a aprender varias cosas sobre el mecanismo que permite a este anfibio recuperar indefinidamente un miembro amastutado. En su opinión, en el futuro nosotros también podremos ganar este “superpoder”, aunque no va a suceder de forma inmediata.
El optimismo viene de la presencia de células progenitora adultas en nuestro cuerpo. Estas células, inicialmente no diferenciadas, pueden transformarse en cualquier clase de tejido: óseo, muscular, nervioso, vascular, etc. Sin embargo, más allá de su funcionalidad “poniendo parches” aquí y allá, no pueden hacer crecer de nuevo un brazo amastutado.
Sin embargo, en el útero materno, los humanos somos capaces de generar sistemas y organos completos. A partir de la información genética, un embrión humano se desarrolla hasta formar una persona en solo nueve meses. De modo que en cierto modo, en nuestros genes existe la información precisa para decirle a las células progenitora dónde deben ubicarse y en qué tejido deben especializarse.
Para regenerar un miembro, las células progenitora necesitan precisamente eso, saber dónde están. De ese modo podrán construir las estructuras necesarias en el orden correcto. Las salamandras posee cierto número de genes que en los humanos figuran “desconectados”. Gardiner cree que tal vez esos genes permitan la regeneración, o al menos ayuden a controlar el proceso. Sin embargo, algo en el pasado evolutivo de los humanos llevó a que esos genes dejasen de expresarse del mismo modo que lo hacen en las salamandras.
Ajolote albino mostrando sus branquias externas. (Crédito imagen: Wikipedia).
¿Qué provocó esa divergencia evolutiva? Nadie lo sabe a ciencia cierta, aunque en 2013 el trabajo de un científico australiano llamado James Godwin (Universidad Monash) hizo un hallazgo que podría dar una pista clave en la resolución del misterio. Godwin descubrió que unas células del sistema inmunitario llamadas macrófagos, evitan en las salamandras la formación de tejido cicatrizal. Los macrófagos existen en otros animales, incluidos los humanos, y su función es la de detener las infecciones y provocar la inflamación, que es la señal que se lanza al cuerpo para indicar que es necesario reparar algo. Cuando se eliminan los macrófagos en el cuerpo de una salamandra, esta es incapaz de regenerar un miembro amastutado. En lugar de eso la herida se cubre con una cicatriz, justo lo que nos sucede a nosotros.
Otro de los aspectos a tener en cuenta si deseamos que los humanos puedan regenerar sus miembros perdidos es la neotenia, que es la capacidad que tienen algunos animales de conservarse jóvenes. El ejemplo más conocido lo tiene una salamandra mexicana llamada ajolote, que es capaz de retener sus características larvarias (es decir esquivar la madurez sensual) a voluntad. Por eso, un ajolote puede mostrar agallas (como un renacuajo) a pesar de haber desarrollado totalmente sus extremidades. Los humanos también poseemos neotenia, lo cual explica que nuestras crías sean las que atraviesan una infancia más larga de entre todos los grandes primates. Eso hace así mismo que la capacidad para curarse sea mayor en los humanos jóvenes que en los mayores.
En este aspecto, investigadores de Harvard descubieron que un gen llamado Lin28a (activo en animales y humanos inmaduros) está detrás de la capacidad que los ratones jóvenes tienen de regenerar tejido. Este gen está relacionado con el sistema de control del metabolismo de los animales, cuando se estimula puede hacer que un animal genere más energía, como si fuera más joven.
Como decía al principio, aún falta bastante tiempo para que los humanos podamos hacer “magia regenerativa” al estilo salamandra, pero la propia natuzaleza nos ofrece ejemplos animales en los que poder buscar soluciones. Quien sabe si ahora mismo hay un estudiante enamorado de la biología evolutiva, que dentro de unas décadas logre juntar todas las piezas del puzzle y resolver el misterio. Confiemos en el ingenio humano y en el avance de la ciencia.
Por cierto que si os parece interesante este tema os recomiendo encarecidamente leer ECM, o de cómo los gorrinos nos ayudan a regenerarnos.
